Explicamos o que são as leis da termodinâmica, qual a origem desses princípios e as principais características de cada um.

Quais são as leis da termodinâmica?
As leis da termodinâmica (ou os princípios da termodinâmica) descrevem o comportamento de três grandezas físicas fundamentais, temperatura, energia e entropia, que caracterizam os sistemas termodinâmicos. O termo “termodinâmica” vem do grego garrafa térmicaque significa “calor” e dínamosque significa “força”.
Matematicamente, esses princípios são descritos por um conjunto de equações que explicar o comportamento dos sistemas termodinâmicosdefinido como qualquer objeto de estudo (desde uma molécula ou um ser humano, até a atmosfera ou água fervendo em uma panela).
Existem quatro leis da termodinâmica e Eles são cruciais para a compreensão das leis físicas do universo e a impossibilidade de certos fenômenos como o movimento perpétuo.
Veja também: Princípio de conservação de energia
Origem das leis da termodinâmica
Os quatro princípios da termodinâmica Eles têm origens diferentes e alguns foram formulados a partir dos anteriores.. O primeiro a ser estabelecido, aliás, foi o segundo, obra do físico e engenheiro francês Nicolás Léonard Sadi Carnot em 1824.
Contudo, em 1860 este princípio foi formulado novamente por Rudolf Clausius e William Thompson, acrescentando então o que hoje chamamos de Primeira Lei da Termodinâmica. O terceiro apareceu mais tarde, também conhecido como “postulado de Nerst” porque surgiu graças aos estudos de Walther Nernst entre 1906 e 1912.
Finalmente, A chamada “lei zero” surgiu em 1930, proposto por Guggenheim e Fowler. Deve-se dizer que não é reconhecido como uma lei verdadeira em todas as áreas.
Primeira Lei da Termodinâmica

A primeira lei é chamada de “Lei da Conservação de Energia” porque determina que em qualquer sistema físico isolado de seu ambiente, a quantidade total de energia será sempre a mesma, embora possa ser transformada de uma forma de energia em diferentes. Ou seja: a energia não pode ser criada nem destruída, apenas transformada.
Desta forma, ao fornecer uma certa quantidade de calor (Q) a um sistema físico, a sua quantidade total de energia pode ser calculada como o calor fornecido menos o trabalho (W) realizado pelo sistema sobre o seu entorno. Expresso em uma fórmula: ΔU = Q – W.
Como exemplo desta lei, imaginemos um motor de avião.. É um sistema termodinâmico composto por um combustível que reage quimicamente durante o processo de combustão, liberando calor e realizando trabalho (que faz o avião se mover). Então: se pudéssemos medir a quantidade de trabalho realizado e o calor liberado, poderíamos calcular a energia total do sistema e concluir que a energia no motor permaneceu constante durante o vôo: a energia não foi criada nem destruída, mas sim alterada a partir de energia química em energia térmica e energia cinética (movimento, isto é, trabalho).
Segunda lei da termodinâmica
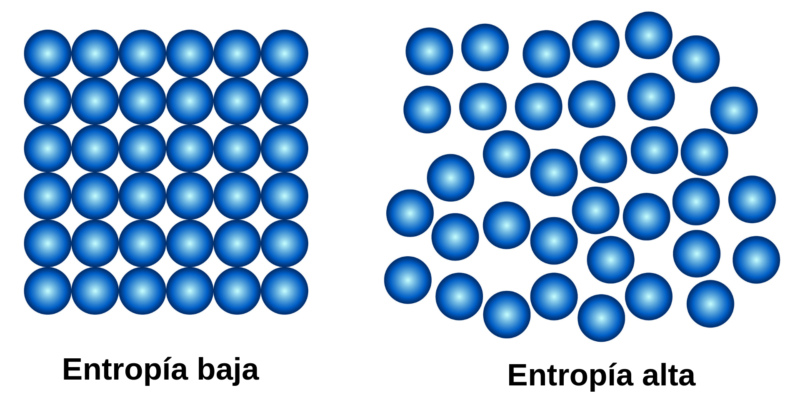
A segunda lei, também chamada de “Lei da Entropia”, pode ser resumida da seguinte forma: a quantidade de entropia no universo tende a aumentar com o tempo. Isso significa que o grau de desordem dos sistemas aumenta até atingir um ponto de equilíbrio, que é o estado de maior desordem do sistema.
Esta lei introduz um conceito fundamental na física: o conceito de entropia (representada pela letra S), que no caso dos sistemas físicos representa o grau de desordem. Acontece que em todo processo físico em que há transformação de energia, uma determinada quantidade de energia não é aproveitável, ou seja, não pode realizar trabalho. Se não puder realizar trabalho, na maioria dos casos essa energia será calor. Esse calor que o sistema libera, o que ele faz é aumentar a desordem do sistema, a sua entropia. A entropia é uma medida da desordem de um sistema.
A formulação desta lei estabelece que A mudança na entropia (dS) será sempre igual ou maior que a transferência de calor (dQ), dividido pela temperatura (T) do sistema. Ou seja, que: dS ≥ dQ/T.
Para entender isso com um exemplo, basta queimar uma certa quantidade de matéria e depois coletar as cinzas resultantes. Ao pesá-los, verificaremos que é menos matéria do que estava em seu estado inicial: parte da matéria foi convertida em calor na forma de gases que não conseguem realizar trabalho no sistema e que contribuem para sua desordem.
Terceira lei da termodinâmica

A terceira lei afirma que A entropia de um sistema que é levado ao zero absoluto será uma constante definida. Em outras palavras:
- Ao atingir o zero absoluto (zero em unidades Kelvin), os processos dos sistemas físicos param.
- Ao atingir o zero absoluto (zero em unidades Kelvin), a entropia possui um valor mínimo constante.
É difícil chegar diariamente ao chamado zero absoluto. (-273,15°C), mas podemos pensar nessa lei analisando o que acontece em um freezer: os alimentos que ali colocamos esfriarão tanto que os processos bioquímicos em seu interior ficarão mais lentos ou até parados. Por isso sua decomposição é retardada e ficará apto para consumo por muito mais tempo.
Lei zero da termodinâmica
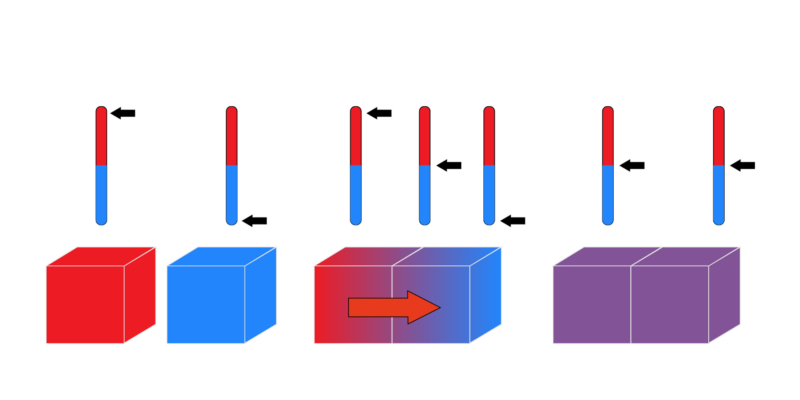
A “lei zero” é conhecida por esse nome embora tenha sido a última a ser proposta. Também conhecido como Lei do Equilíbrio Térmico, este princípio dita que: “Se dois sistemas estão em equilíbrio térmico independentemente de um terceiro sistema, eles também devem estar em equilíbrio térmico entre si.” Pode ser expresso logicamente da seguinte forma: se A = C e B = C, então A = B.
Esta lei nos permite comparar a energia térmica de três corpos diferentes A, B e C. Se o corpo A está em equilíbrio térmico com o corpo C (eles têm a mesma temperatura) e B também tem a mesma temperatura que C, então A e B têm a mesma temperatura.
Outra forma de afirmar este princípio é argumentar que quando dois corpos com temperaturas diferentes são postos em contacto, trocam calor até que as suas temperaturas se tornem iguais.
Exemplos cotidianos desta lei são fáceis de encontrar. Quando nos colocamos em água fria ou quente, notaremos a diferença de temperatura apenas nos primeiros minutos já que nosso corpo entrará então em equilíbrio térmico com a água e não notaremos mais a diferença. O mesmo acontece quando entramos em uma sala quente ou fria: a princípio notaremos a temperatura, mas depois deixaremos de notar a diferença porque entraremos em equilíbrio térmico com ela.
Referências
- “Princípios da termodinâmica” na Wikipedia.
- “Leis da termodinâmica” no Blog do Geofrik.
- “As leis da termodinâmica” na Khan Academy.
- “Termodinâmica” na Enciclopédia Britânica.
- “As leis da termodinâmica em 5 minutos” (Vídeo) em Quantum Fracture.